中科项目文章|磷酸化修饰组学揭示效应因子蛋白功能
嗜肺军团菌是一种可引起非典型肺炎的致病菌。它的主要毒力决定因素是IVB型分泌系统,它向宿主细胞输送约330种效应蛋白,从而调节各种细胞过程,实现侵染过程。尽管科研工作者付出巨大的努力,仍只有10%的效应因子的作用机制被明确。因此,效应因子的功能研究能够帮助我们更加深入地了解嗜肺杆菌与宿主相互作用的分子机制。而在本文中,中山大学的研究团队针对WipA蛋白这个效应因子的功能进行深入的探讨。中科新生命十分荣幸参与了酪氨酸磷酸化修饰蛋白质组学分析工作。
关键词:肌动蛋白聚合;嗜肺军团菌;磷酸蛋白质组学;WipA
The Legionella pneumophila effector WipA disrupts host F-actin polymerisation by hijacking phosphotyrosine signaling
Cellular Microbiology IF=4.288
技术路线:
探索攻略:
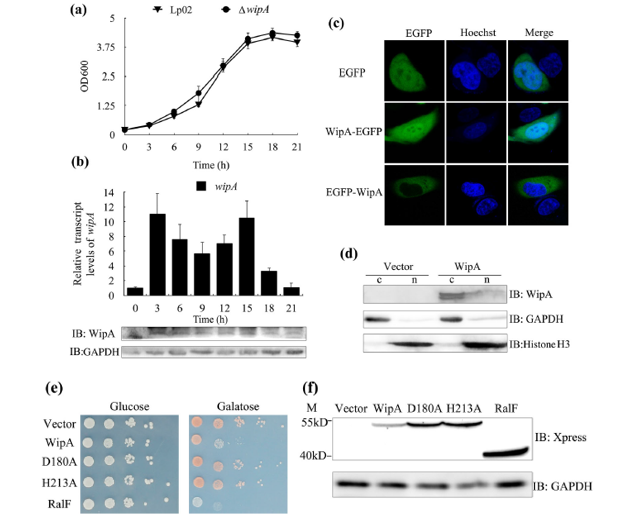
1. WipA的表达、定位和毒性分析
作者构建WipA缺失突变体,通过分析嗜肺军团菌在体外生长周期中指定时间点WipA的转录和翻译水平,发现WipA可能在嗜肺杆菌感染的传播和复制阶段都起作用。对WipA在哺乳动物细胞中的定位研究发现,WipA存在于细胞核和细胞质中。为了确定WipA在真核细胞中的细胞毒性,以啤酒酵母芽胞杆菌为替代宿主,用半乳糖诱导启动子表达WipA。结果表明,WipA以酶活性依赖的方式诱导了酵母的生长缺陷。
2. 酪氨酸磷酸蛋白质组分析
为了探索WipA的蛋白功能,研究团队利用酪氨酸磷酸蛋白质组学分析野生型与突变体军团菌感染小鼠巨噬细胞,酪氨酸磷酸化水平的系统变化。共检测到671个蛋白的1123个酪氨酸磷酸化位点,相对于wipA过表达组(Lp02‐ΔwipA‐pWipA)而言,在wipA缺失组(Lp02‐ΔwipA)有44个氨基酸位点的酪氨酸磷酸化水平上调,36个位点下调。
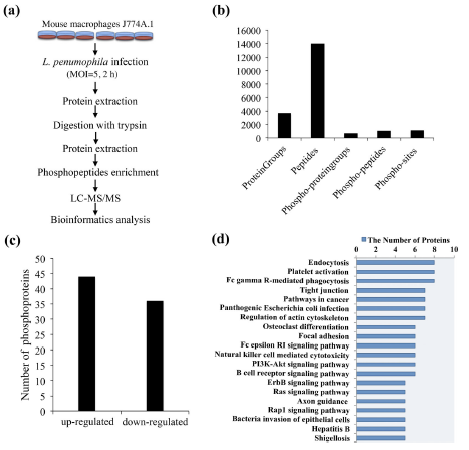
生物信息学分析,以确定嗜肺杆菌感染期间磷酸蛋白质组变化的功能后果和潜在的信号通路。结果表明,WipA可能参与胞吞作用、FcγR介导的吞噬作用、紧密连接和肌动蛋白细胞骨架通路的调节。
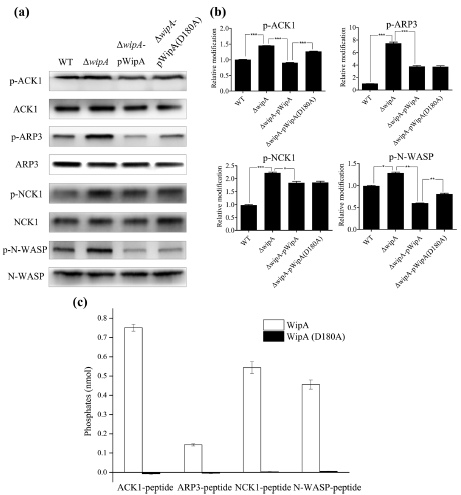
3. 组学结果验证
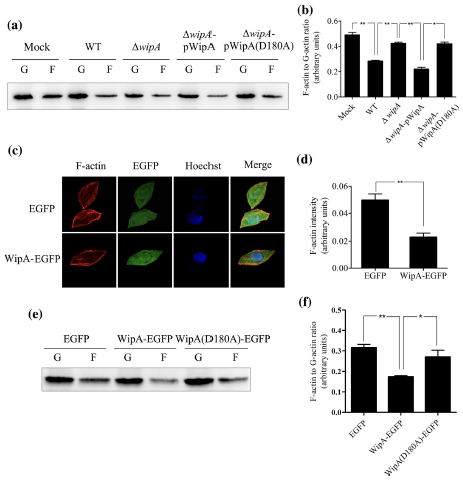
为验证组学结果,作者在参与肌动蛋白聚合信号通路中挑选4种差异表达的磷酸化蛋白进行Western blotting分析。结果显示,与野生型菌株感染细胞相比,挑选的4种蛋白在突变株感染细胞(ΔwipA,ΔwipA‐pWipA和ΔwipA‐pWipAD180A)中的磷酸化水平相对较高,表明WipA降低肌动蛋白聚合相关蛋白的酪氨酸磷酸化水平。
4. WipA蛋白功能分析
肌动蛋白有两种形式:G-actin(球状)和F-actin(丝状),两种形式之间的相互转换是精确调节的。F/G‐actin比率反映了肌动蛋白聚合和解聚之间的平衡。因此,在后续的功能分析中,研究团队着重研究了目标蛋白对F/G‐actin比率的影响。免疫荧光分析显示,表达WipA-EGFP的细胞中的f-actin水平明显低于表达EGFP的细胞。Western blotting实验结果表明,表达WipA-EGFP的细胞以酶活性依赖的方式显示出F/G‐actin比率显著降低。总的来说,这些数据表明WipA通过降低F/G‐actin比率来抑制F-actin的聚合。
5. WipA作用机制探讨
根据之前的文献报道,LegK2也同样可以抑制肌动蛋白的聚合。为了确认这WipA与LegK2的功能,研究人员构建了wipA、legK2或wipA/legK2双敲除菌株。结果表明,嗜肺杆菌的细胞内复制需要WipA和LegK2。
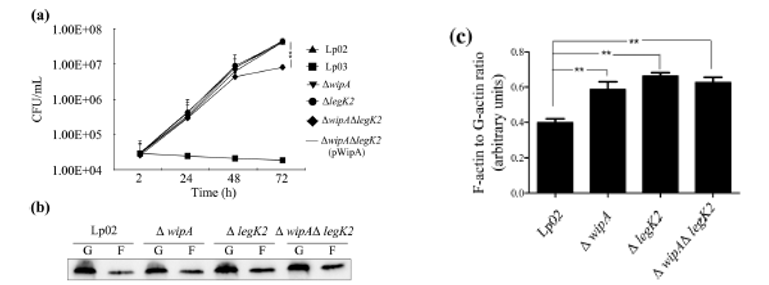
为了明确肌动蛋白聚合情况,研究人员用嗜肺杆菌突变株感染J774A.1细胞2小时,并用蛋白质印迹法分别检测F-actin和G-actin表达水平。与野生型菌株相比,突变菌株诱导的F/G‐actin比率显著增加。这些结果表明,WipA的缺失并不会对legK2突变体的肌动蛋白聚合产生进一步的影响。
小结:
在这项研究中,研究者利用磷酸蛋白质组学策略分析WipA靶向的宿主细胞途径,并挑选一些参与宿主细胞肌动蛋白聚合的差异磷酸化蛋白质作为进一步研究的对象。
Western blotting进一步证实WipA能使一些与肌动蛋白聚合相关的蛋白质去磷酸化。这些实验证明WipA通过减少感染期间G-actin到F-actin的转变来抑制宿主F-actin的聚合。
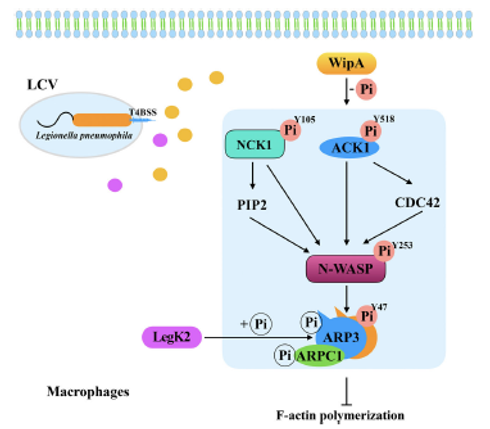
这项研究为WipA介导的宿主肌动蛋白聚合的调节提供了独特的见解,并帮助我们阐明了L. pneumophila感染的致病机制。
中科新生命修饰蛋白质组学升级啦↓↓↓


